Contoh Soal Kimia Kelas 10 Kurikulum 2013 Terbaru
Contoh Soal Kimia Kelas 10 - Soal ini merupakan kumpulan contoh soal kimia kelas 10.
Soal kimia kelas 10 ini terdiri dari 35 soal pilihan ganda dengan pilihan jawaban
a,b,c,d, dan e dan esay 5 soal. Soal kimia dapat digunakan sebagai
soal ulangan harian, soal ulangan akhir sekolah (UAS), soal penilaian akhir sekolah sistem operasi.
Soal kimia untuk kelas 10 ini menggunakan kurikulum 2013
revisi. Kompetensi dasar yang digunakan pada soal ini sudah mengacu
kurikulum 2013 revisi. Untuk lebih jelasnya, berikut merupakan contoh soal kimia kelas 10.
Soal Kimia Kelas 10
Terdapat dua jenis soal kimia untuk kelas 10 yang digunakan yaitu pilihan ganda dan essay atau uraian. Untuk lebih jelasnya berikut merupakan pembahasan mengenai soal kimia kelas 10 yaitu:
A. Soal Pilihan Ganda Kimia
1. Atom merupakan bola pejal bermuatan positif dan elektron tersebar merata dalam atom. Teori atom ini dikemukakan oleh ….
A. J. J. Thompson D. Rutherford
B. Niels Bohr E. Louis de broglie
C. Jhon Dalton
2. Unsur (_26^56)Fe mempunyai jumlah proton, neutron, dan elektron berturut-turut adalah ….
A. 26, 56, dan 26 D. 26, 30, dan 26
B. 26, 26, dan 30 E. 56, 30, dan 56
C. 30, 30, dan 26
3. Pasangan unsur yang merupakan isotop adalah ….
A. (_11^24)Na dan (_11^23)Na D. (_7^14)N dan (_19^39)K
B. (_11^24)Na dan (_16^32)S E. (_20^40)Ca dan (_18^36)Ar
C. (_8^16)O dan (_6^12)C
4. Konfigurasi elektron pada unsur dengan nomor atom 20 adalah ….
A. 2. 8. 10 D. 2. 8. 7. 3
B. 2. 8. 8. 2 E. 2. 8. 6. 4
C. 2. 8. 9. 1
5. Jumlah elektron valensi yang dimiliki unsur dengan nomor atom 31 adalah ….
A. 1 D. 5
B. 3 E. 7
C. 4
6. Unsur X dengan nomor atom 19 dalam tabel periodik terdapat pada ….
A. Golongan IA, perioda 3 D. Golongan VIA, perioda 4
B. Golongan VIA, perioda 3 E. Golongan IA, perioda 4
C. Golongan IIIA, perioda 4
7. Diantara unsur berikut yang mempunyai energi ionisasi terbesar adalah ….
A. (_11^)Na D. (_19^)K
B. (_12^)Mg E. (_20^)Ca
C. (_13^)Al
8. Galium di alam terdiri atas 2 jenis isotop yaitu Ga-69 dengan kelimpahan 60 % dan Ga-71 dengan kelimpahan 40 %. Massa atom relatif galium adalah ….
A. 69,8 D. 71,4
B. 70,2 E. 71,6
C. 70,9
9. Menurut Newlands, unsur ketiga akan mempunyai sifat yang sama dengan unsur ke ….
A. 4 D. 9
B. 7 E. 10
C. 8
10. Senyawa berikut yang mempunyai massa molekul relatif ( Mr = 60 ) adalah ….( Na=23, N=14, O=16, Ca=40, Cl=35,5, H=1, C=12, S=32 )
A. NaNO3 D. C6H12O6
B. CaCl2 E. H2SO4
C. CO(NH2)2
11. Diantara unsur-unsur berikut yang bersifat stabil adalah ….
A. (_11^)Na D. (_23^)V
B. (_16^)S E. (_8^)O
C. (_18^)Ar
12. Diketahui unsur-unsur dengan nomor atomnya sebagai berikut :
(_10^)A , (_12^)B , (_13^)C, dan (_16^)D. Pasangan unsur yang dapat membentuk ikatan ion adalah ….
A. A dan B D. B dan D
B. B dan C E. A dan D
C. A dan C
13. Unsur P dengan nomor atom 20 membentuk ikatan dengan unsur Q bernomor atom 15. Rumus kimia yang terbentuk adalah ….
A. PQ2 D. P2Q3
B. P2Q E. P3Q2
C. PQ3
14. Kelompok senyawa berikut yang ini yang seluruhnya berikatan ion adalah …. (nomor atom H=1, C=6, O=8, N=7, Mg=12, Cl=17, Ca=20, K=19, S=16, P=15, Br=35 )
A. CaCl2, CaO, dan H2O D. KCl, NaCl, dan PCl5
B. MgCl2, NO2, dan SO2 E. CH4, H2O, dan Br2
C. KCl, CaO, dan NaCl
15. Untuk mencapai kestabilannya unsur (_17^36)X cenderung ….
A. Melepas 1 elektron D. Menerima 7 elektron
B. Melepas 7 elektron E. Menerima 8 elektron
C. Menerima 1 elektron
16. Unsur A dengan nomor atom 14 membentuk ikatan dengan unsur B bernomor atom 17. Rumus kimia yang terbentuk adalah ….
A. AB D. AB4
B. AB2 E. A2B3
C. A2B
17. Kelompok senyawa berikut yang ini yang seluruhnya berikatan kovalen adalah …. (nomor atom H=1, C=6, O=8, N=7, Mg=12, Cl=17, Ca=20, K=19, S=16, P=15, Br=35 )
A. CaCl2, CaO, dan H2O D. KCl, NaCl, dan PCl5
B. MgCl2, NO2, dan SO2 E. CH4, H2O, dan Br2
C. KCl, CaO, dan NaCl
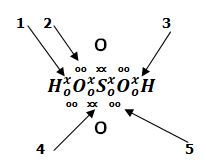
18. Berdasarkan gambar di bawah ini, yang menunjukkan ikatan kovalen koordinasi adalah nomor ….
A. 1 D. 4B. 2 E. 5
C. 3
19. Molekul unsur berikut yang mempunyai ikatan kovalen rangkap dua adalah ….
A. H2 ( nomor atom H =1 ) D. F2 ( nomor atom F=9 )
B. O2 ( nomor atom O=8 ) E. Cl2 ( nomor atom Cl=17 )
C. N2 ( nomor atom N=7 )
20. Di antara molekul berikut yang bersifat non polar adalah ….
A. PCl3 D. CS2
B. H2S E. OF2
C. NH3
21. Nama yang paling tepat untuk senyawa dengan rumus N2O adalah ….
A. Dinitrogen oksida D. Dinitrogen monoksida
B. Nitrogen dioksida E. Nitrogen monoksida
C. Nitrogen oksida
22. Nama senyawa dengan rumus kimia CaCl2 adalah ….
A. Kalsium klorida D. Kalsium (I) klorida
B. Kalsium diklorida E. Kalsium monoklorida
C. Kalsium (II) klorida
23. Nama senyawa dengan rumus kimia P2O5 adalah ….
A. Fosfor oksida D. Difluor pentaoksida
B. Difosfor pentaoksida E. Vanadium oksida
C. Fluor oksida
24. Penamaan senyawa berikut yang benar adalah ….
A. Al2O3 : aluminium (III) oksida D. HgCL2 : Raksa (I) klorida
B. PbSO4 : Timbal (II) sulfat E. Fe(NO3)3 : besi nitrat
C. N2O4 : dinitrogen trioksida
25. Rumus kimia garam yang benar berdasarkan tabel kation dan anion :
Kation Anion
Al3+ NO3-
Mg2+ PO43-
NH4+ SO42-
adalah ….
A. Al2SO4 D. Mg3(PO4)2
B. Al3PO4 E. (NH4)3NO3
C. Mg2SO4
26. Bilangan kuantum spin menunjukkan ....
A. Orientasi orbital D. Bentuk orbital
B. Tingkat energi utama E. Ukuran orbital
C. Arah rotasi elektron
27. Harga keempat bilangan kuantum yang diizinkan untuk elektron pada sub kulit 4p adalah ....
A. n = 3 l = 2 m = 0 s = + ½ D. n = 4 l = 1 m = -1 s = - ½
B. n = 4 l = 0 m = -1 s = + ½ E. n = 4 l = 2 m = 2 s = - ½
C. n = 3 l = 3 m = 3 s = + ½
28. Jika atom pusat dilambangkan A, pasangan elektron bebas E dan pasangan elektron terikat X. Maka notasi VSEPR untuk molekul XeF4 adalah....
( nomor atom Xe = 54, F = 9 )
A. AX3E D. AX4E
B. Ax2E2 E. AX4E2
C. AX3E2
29. Ikatan hidrogen terjadi antar molekul ....
A. HBr D. CH4
B. H2O E. PH3
C. HCN
30. Pengertian dari larutan elektrolit adalah..
A. Larutan yang mengandung listrik D. Larutan yang dapat menghantarkan arus listrik
B. Larutan yang tidak dapat menghantarkan arus listrik E. Semua benar
C. Larutan yang berbuasa dan terdapat gelembung
31. Partikel penyusun inti atom adalah ….
A. Proton D. Proton dan neutron
B. Neutron E. Proton, neutron, dan elektron
C. Neutron dan elektron
32. Konfigurasi elektron untuk ion Cr3+ (nomor atom Cr = 24) adalah ....
A. 1s2 2s2 2p6 3s2 3p6 4s2 4p1 D. 1s2 2s2 2p6 3s2 3p6 4s1 3d8
B. 1s2 2s2 2p6 3s2 3p5 3d4 E. 1s2 2s2 2p6 3s2 3p6 4s2 3d7
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d1
33. Rumus kimia glukosa adalah ….
A. CaCO3 D. HCOH
B. CH3COOH E. CO(NH2)2
C. C6H12O6
34. Ion di bawah ini memiliki konfigurasi seperti gas (_10^)Ne, kecuali ….
A. (_11^)Na+ D. (_16^)S2-
B. (_12^)Mg2+ E. (_8^)O2-
C. (_13^)Al3+
35. Unsure (_38^)X dan unsur (_8^)Y akan membentuk senyawa ….
A. XY dengan ikatan ion D. XY2 dengan ikatan kovalen
B. XY dengan ikatan kovalen E. X2Y dengan ikatan ion
C. XY2 dengan ikatan ion
Soal Essay Kimia
36. Diketahui unsur (_15^31)P. Berdasarkan unsur tersebut, tentukan :
a. jumlah proton, neutron, dan elektron
b. konfigurasi elektron
c. golongan dan periode
37. Tentukan massa molekul relative (Mr) dari senyawa berikut :
a. H2 ( SO4)2 b. Ca3(PO4)3
( Ar H=1, S=32, O=16, Ca=40, P=31 )
38. Diketahui unsur A dengan nomor atom 15 dan unsur B dengan nomor atom 9. Tentukan rumus kimia dan jenis ikatan yang terjadi !
39. Tuliskan nama senyawa-senyawa berikut :
a. NO5
b. Mg2SO4
40. Konfigurasi elektron untuk ion Cr2- (nomor atom Cr = 24) berapa konfigurasi kuantum azimut dan tentukan diagram orbitalnya!
Diatas merupakan pembahasan mengenai contoh soal kimia kelas 10 yang dapat digunakan sebagai bahan penilaian. Semoga dapat menambah wawasan dan pengetahuan.

Post a Comment for "Contoh Soal Kimia Kelas 10 Kurikulum 2013 Terbaru"